导语:从经典认知到临床新发现——T790M突变与EGFR原发突变的关系初探
超过50%的亚裔晚期肺腺癌患者,体内存在EGFR基因的原发敏感突变。这使得靶向药物成为他们首选的“特效药”。然而,平均9-13个月后,耐药往往不期而至,其中约一半的病例要“归咎”于一个名为T790M的位点突变。传统的教科书告诉我们,T790M是“获得性”耐药突变,是在药物压力下“逼”出来的。但临床上,越来越多的精准检测报告揭示了一个更复杂的图景:T790M突变会不会和EGFR原发突变同时存在? 答案是肯定的。这种现象正在颠覆我们简单的线性认知,也把肺癌的个体化治疗推向了更精细的层面。
理解基础:什么是EGFR原发突变与T790M耐药突变?
要搞懂“共存”,得先明白这两个突变各自是干什么的。
你可以把EGFR基因想象成控制细胞生长的一把“钥匙孔”。常见的原发突变,比如19号外显子缺失或L858R点突变,相当于把这个钥匙孔的形状永久性地改变了——变得特别容易被“激活”,导致细胞生长信号失控,疯狂增殖。第一代、第二代靶向药(如吉非替尼、厄洛替尼、阿法替尼)就是专门设计来堵住这个“畸形钥匙孔”的精准“橡皮塞”,效果立竿见影。
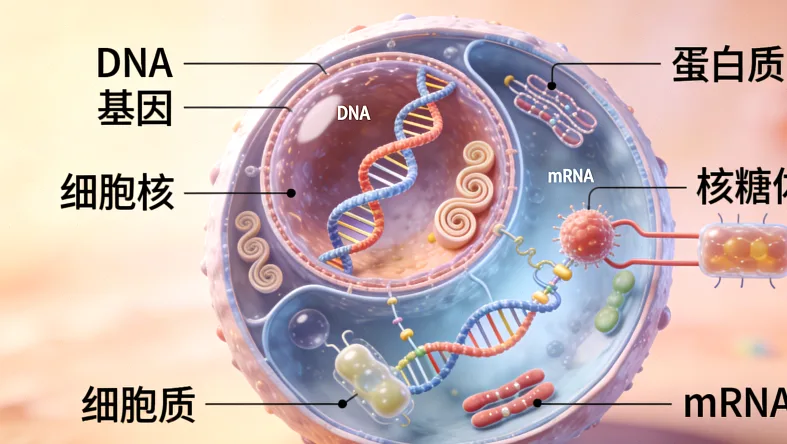
那T790M又是什么角色呢?它被称为“守门员”突变。这个突变发生在EGFR基因的第790号氨基酸位点上,相当于在原来的钥匙孔旁边,又加固了一道厚重的“防盗门”。这道门不仅让原本的“橡皮塞”(一代/二代药)再也塞不进去,甚至还可能让细胞自身的“钥匙”(配体)更容易打开它,导致信号更强。所以,一旦T790M出现,前两代药物基本就失效了。
核心问题解答:T790M突变可能与EGFR原发突变同时存在
回到我们最核心的问题:T790M突变会不会和EGFR原发突变同时存在? 不仅可能,这在临床上已经不是一个罕见现象。它主要分两种情景:
一种是“原发性共存”。极少数患者(研究数据约在1%-5%之间),在从未使用过任何靶向药之前,通过高灵敏度的检测,就能在肿瘤组织或血液里同时找到EGFR原发突变和T790M突变的踪迹。这好比敌人一上来就配备了高级防御工事。

另一种更常见的是“继发性共存”。这发生在靶向治疗过程中。由于肿瘤本身具有“异质性”——我们待会会细讲——可能一开始只有少数癌细胞携带T790M突变,药物杀死了没有T790M的敏感细胞,而这些携带T790M的“顽固分子”就逐渐壮大,成为主流。在耐药后的检测中,我们看到的也是两者共存的状态,但此时的T790M突变比例通常已大大升高。
所以,无论是初治还是耐药后,“同时存在”都是一个需要被严肃对待和精准识别的客观状态。
深入机制:原发共存的可能原因与肿瘤异质性的影响
为什么会有原发性共存?它的根源在于肿瘤的进化。癌细胞在生长过程中,基因会不断发生随机变异。可能在肿瘤发展的早期,某个细胞亚群就“偶然”获得了T790M突变。这个亚群和那些只携带原发突变的细胞亚群一起,构成了肿瘤的“混合军团”。只是T790M亚群的比例起初很低,常规检测可能发现不了。
这就引出了一个贯穿肺癌治疗始终的核心概念:肿瘤异质性。它指的是同一个患者的肿瘤内部,或者不同的转移病灶之间,癌细胞的基因特征可能各不相同。就像一片森林里,不只有松树,还可能夹杂着橡树和桦树。
异质性完美解释了“共存”的复杂性。初治时,不同病灶可能携带不同突变;治疗中,药物对敏感细胞进行“选择压力”,让原本弱势的耐药细胞亚群“脱颖而出”。理解异质性,就明白了为什么一次活检不能代表全身,也明白了动态监测的极端重要性。忽视这种共存,可能会从一开始就为治疗埋下隐患。
临床检测的关键:如何准确发现“共存”状态?
既然共存现象存在且重要,怎样才能把它“揪”出来呢?关键在于检测技术的“火眼金睛”。
传统的检测方法灵敏度有限,只有当T790M突变细胞占到一定比例(比如5%以上)时才能报告。这对于那些低频的原发共存或早期继发信号,很容易漏检。现在,更先进的数字PCR(ddPCR)或下一代测序(NGS)技术,灵敏度可以提升到千分之一甚至万分之一,极大提高了发现“共存”微小信号的能力。
样本选择也有讲究。组织活检是“金标准”,能反映穿刺点的突变情况,但受限于肿瘤异质性,可能无法代表全身。而液体活检(检测血液中的循环肿瘤DNA,即ctDNA)则提供了一种全身性的、无创的“雷达扫描”,特别适合用于耐药后的监测和动态追踪。对于评估T790M突变会不会和EGFR原发突变同时存在这个问题,结合组织与血液的检测,往往能给出更全面的答案。我的临床建议是,初治时尽可能使用高灵敏度NGS进行全景检测;治疗期间,定期通过血液ctDNA监测,一旦发现耐药苗头,立即进行精准的耐药机制探查。
治疗策略的抉择:当两者共存时如何选择靶向药物?
检测出了共存,治疗怎么办?策略因场景而异。
对于初治即发现T790M与EGFR原发突变共存的患者,这直接影响了前线药物的选择。如果T790M突变丰度较高,意味着使用一代/二代药,很可能在短期内就因原发耐药而失败。此时,直接使用第三代EGFR-TKI药物(如奥希替尼、阿美替尼等)成为一种更具前瞻性的强力选择。这类药物能同时抑制原发突变和T790M突变,相当于“双靶点锁定”,从起点上压制耐药克隆,可能获得更长的无进展生存期。
对于治疗过程中出现的继发共存,策略相对明确:换用三代TKI是标准选择。但这里也有学问。如果共存是通过高灵敏度液体活检早期发现的,甚至在影像学进展前就捕捉到ctDNA中T790M信号的升高,这就是“分子进展”。此时与医生充分沟通,考虑提前干预、转换治疗,可能比等到临床进展再处理更为主动。
面对复杂的共存和异质性,未来的方向可能是更灵活的“联合策略”或“序贯策略”,但这一切都必须建立在精准、动态的基因监测图谱之上。
总结与展望:精准检测引领肺癌全程管理
聊了这么多,我们可以清晰地看到,T790M突变会不会和EGFR原发突变同时存在早已不是一个理论问题,而是直接影响临床决策的现实挑战。从“先后发生”到“可能共存”,这一认知的转变,标志着肺癌诊疗进入了“微观进化”管理的新阶段。
核心要点很明确:第一,肺癌的基因状态是复杂且动态变化的,肿瘤异质性是常态。第二,发现共存依赖高灵敏度、多维度的精准检测技术,不能“一检定终身”。第三,治疗策略必须基于这份精细的基因图谱来个体化制定,无论是初治的“高点位打击”,还是耐药的“精准转换”。
作为医生,我深感肺癌的治疗就像一场与狡猾对手的持久博弈。我们手中的武器(靶向药)越来越精良,但取胜的关键,越来越依赖于对敌情(基因突变)实时、准确的情报侦察。把每一次检测都做到位,把每一个突变信号都解读清楚,我们才能为患者绘制出最有的放矢的治疗路线图,真正实现肺癌的慢病化管理。




